渐冻症的新希望|李春岩院士团队基于CRISPR基因编辑有效治疗ALS模型小鼠
肌萎缩侧索硬化( amyotrophic lateral sclerosis,ALS)是一种神经退行性疾病,其特征是大脑皮层、脑干和脊髓中的运动神经元选择性丧失。
“至今尚未有可及的有效药物。”
超氧化物歧化酶(SOD1)突变是肌萎缩性脊髓侧索硬化症(ALS)最主要的原因之一,突变的SOD1通过毒性作用导致运动神经元变性,而修改突变的SOD1基因是治疗与该基因突变相关的ALS患者的最佳方法。
由腺相关病毒(AAV)系统传递的规律间隔成簇短回文重复序列(CRISPR)/CRISPR-associated (Cas9)/sgRNA是中枢神经系统(CNS)基因组编辑的强大工具。
Gene Therapy上刊登的《The deletion of mutant SOD1 via CRISPR/Cas9/sgRNA prolongs survival in an amyotrophic lateral sclerosis mouse model》一文中测试了AAV-SaCas9-sgRNA系统在转基因SOD1G93A小鼠中修饰突变体SOD1的能力。

SOD1-G93A模型小鼠(也称为G93A-SOD1)具有人类SOD1的G93A突变体形式的转基因表达。突变的SOD1具有毒性,会导致运动神经元变性,杂合子在人类中表现出与肌萎缩性侧索硬化症(ALS)类似的表型,可用于研究包括肌萎缩性侧索硬化症在内的神经肌肉疾病。

设计5个靶向sgRNA,通过荧光素酶报告基因法筛选,并用Western Blot检测蛋白水平,发现sgRNA1和sgRNA5的活性比其他sgRNAs更优越。
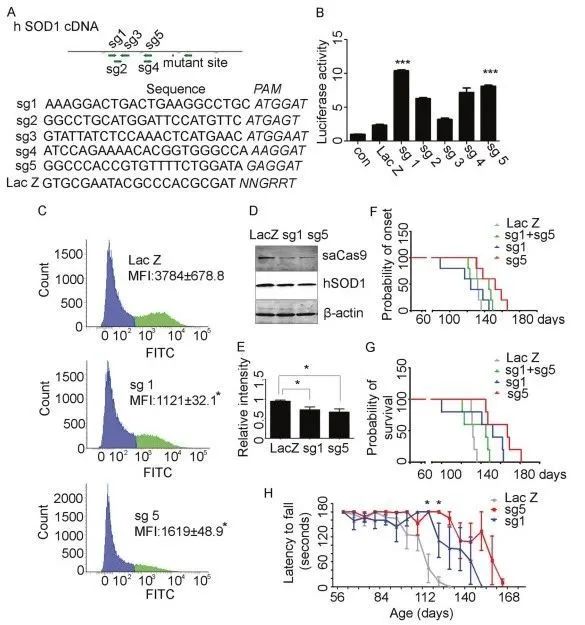
图1 体外和体内中SOD1基因编辑的活性
评估ICV注射后sgRNA1和5对SOD1G93A转基因小鼠的治疗效果差异
新生SOD1G93A转基因小鼠注射AAV9-SaCas9-LacZ(对照)、AAV9-SaCas9-sgRNA1、AAV9-SaCas9-sgRNA5或AAV9-SaCas9-sgRNA1和AAV9-SaCas9-sgRNA5的混合物(1.2×1011vg/pup)。
延缓发病时间:与注射了AAV9-SaCas9-LacZ的对照组小鼠比较,注射了AAV9-SaCas9-sgRNA1、AAV9-SaCas9-sgRNA5的小鼠显著延缓了发病时间,其中注射AAV9 SaCas9-sgRNA5的小鼠的结果最为显著。
提高生存率:不同AAV9-SaCas9-sgRNAs处理的转基因小鼠,特别是AAV9-SaCas9-sgRNA5相比对照AAV9-SaCas9-LacZ处理的小鼠存活率显著提高(图1G和表1)
此外,转棒测试也表明AAV9-SaCas9-sgRNA5治疗组的运动功能也有较好的保留(图1H)。
值得注意的是,接受AAV9-SaCas9-sgRNA5治疗的SOD1突变小鼠的生存期显著延长,但这些小鼠从发病到死亡的时间比对照组短,为了排除SOD1拷贝数带来的影响,研究团队分析SOD1拷贝数后,发现AAV9-sgRNAs处理组与对照组之间没有差异(表1)。
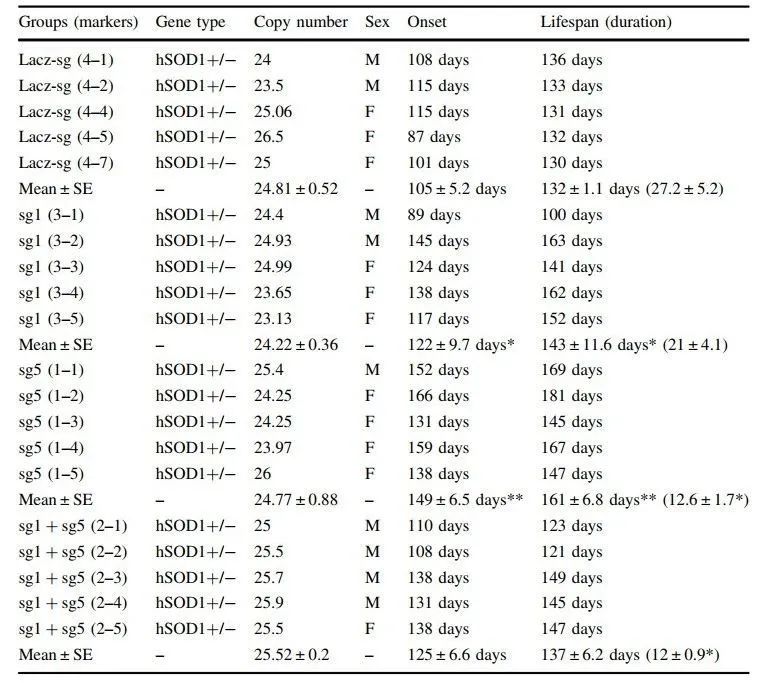
表1 AAV9-SaCas9- sgRNAs和LacZ对小鼠拷贝数、性别、发病及寿命的影响辑的活性
行为表现测试治疗效果
为了进一步评价SOD1 sgRNAs在ALS小鼠模型中的治疗作用,通过行为表现测试来证实治疗的效果,即117天时后肢伸展的评估和115、125天时足印的评估。
对照组小鼠发病后表现为震颤、行走不平衡、后肢肌肉萎缩、体重减轻和呼气困难,病情在~4周内严重恶化。
后肢伸展评估:与对照组相比,AAV9-SaCas9-sgRNA1和AAV9-SaCas9-sgRNA5治疗117 天时,拉伸宽度明显改善(图 2A,B)。
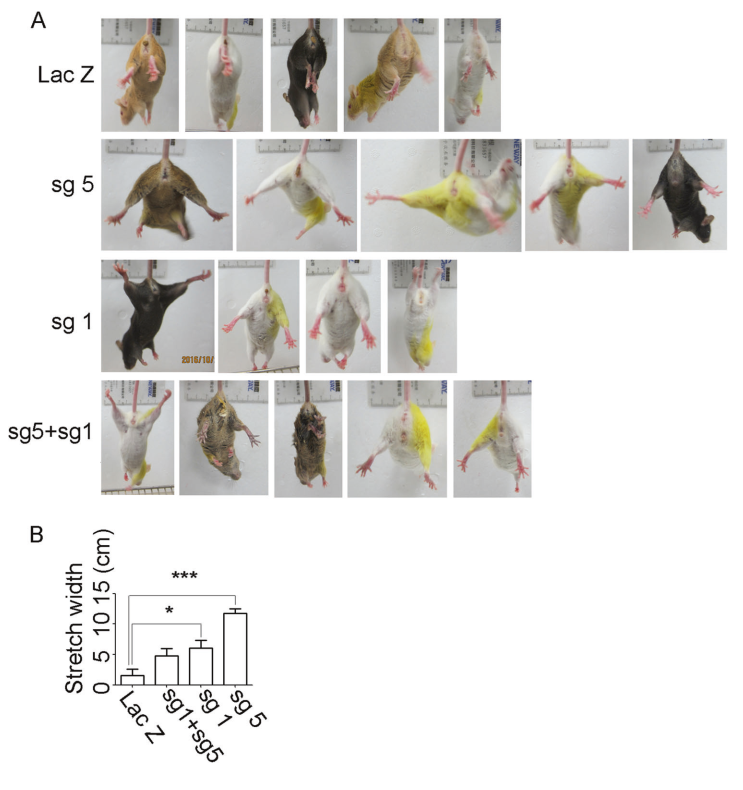
图2 AAV9-SaCas9-sgRNAs (sg1、sg5或sg1+sg5)和AAV9-SaCas9-sgLacZ(LacZ)处理的SOD1G93A小鼠后肢拉伸评估。
足印评估:在小鼠115和125天分析两个连续的后肢脚印之间的最长距离。AAV9-SaCas9-LacZ、AAV9-SaCas9-sgRNA1、AAV9-SaCas9-sgRNA5和sgRNA1 + sgRNA5处理小鼠115天的平均步长分别为3.2±0.7 cm、5.7±0.32 cm、5.98±0.29 cm和4.16±1.22 cm(图3A、B)。
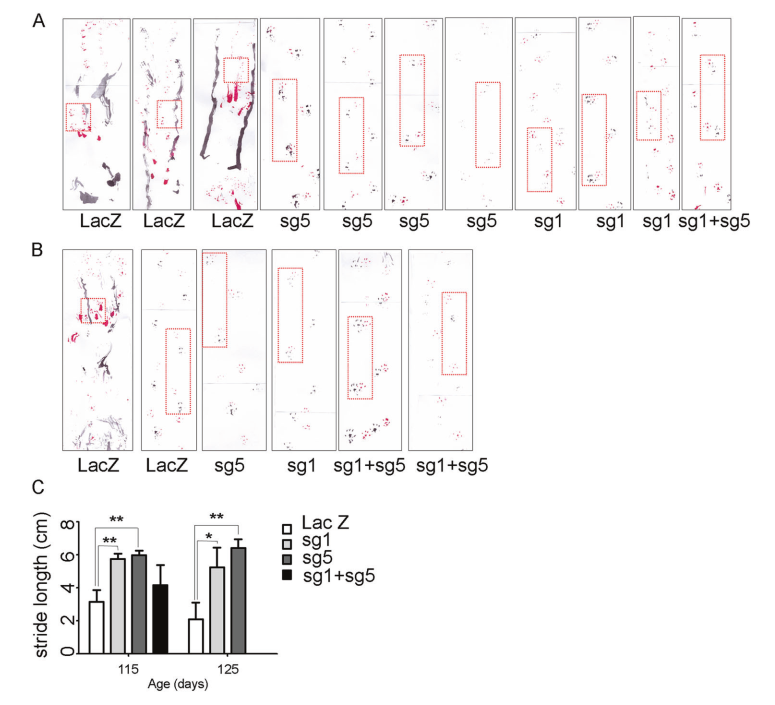
图3 AAV9-SaCas9-sgRNAs (sg1、sg5或sg1+sg5)与对照AAV9-SaCas9sgLacZ(LacZ)处理SOD1G93A小鼠的行为分析
评估AAV9 SOD1 sgRNAs对运动神经元的保护作用
为了直接观察AAV9-SOD1-sgRNA对运动神经元的保护作用,通过Neu N和IBA 1染色以及荧光显微镜观察小鼠的神经元和小胶质细胞。
图4A:与对照组相比,AAV9-SaCas9-sgRNA5保留了相当数量的运动神经,但并没有明显改变IBA1阳性小胶质细胞的激活(如图4 A)。
为了证实运动神经元的保存是由于SOD1 AAV9 sgRNA敲除了SOD1,分析治疗后小鼠运动神经元中SaCas9和SOD1的表达。
图4B:在对照组小鼠的脊髓运动神经元中检测到强突变体SOD1染色,但在AAV9-SaCas9-sgRNAs处理小鼠的SaCas9阳性运动神经元中观察到非常弱的突变体SOD1染色。
因此,注射AAV9-SaCas9-sgRNA5的小鼠表现明显优于对照组小鼠。
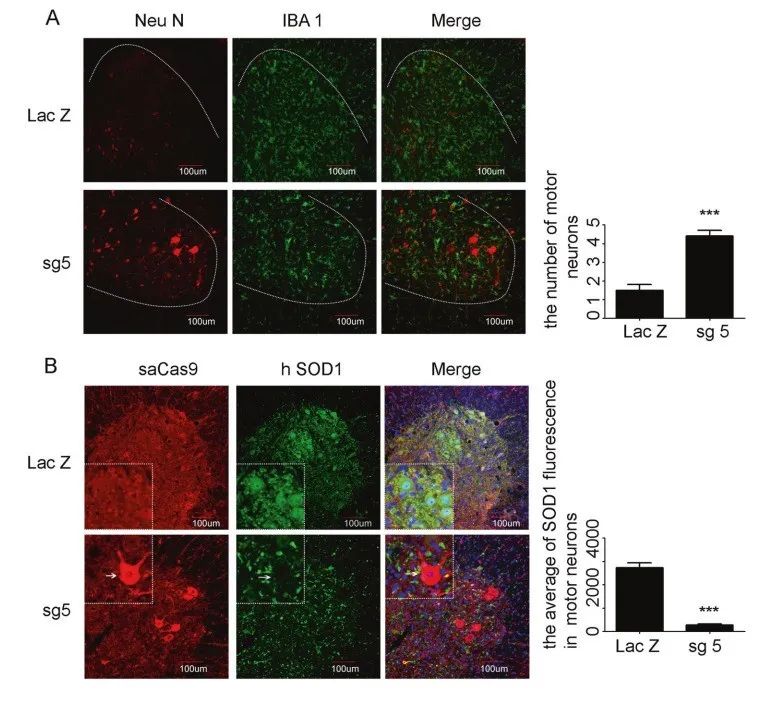
图4 1.2×1011vg/pup 剂量SOD1 sgRNAs给予运动神经元的保护
高剂量AAV9-SaCas9-sgRNA5进一步改善ALS动物模型的表型
为了研究AAV9-SaCas9-sgRNA5是否能进一步改善ALS动物模型的表型,给SOD1G93A转基因小鼠注射4×1011 vg 的AAV9-SaCas9-sgRNA5,其剂量比以往(1.2×1011 vg)高3.3倍。
中位生存期显著提高:与AAV9-SaCas9-LacZ处理的对照组小鼠相比,转基因小鼠的中位生存期显著提高54.6%(图5A)。
改善肌肉强度:通过对转棒时的表现和重量的评价,判断高剂量AAV9-SaCas9-sgRNA5明显改善后肢的瘫痪和肌肉萎缩(图5 B、C)。
恢复运动能力:在小鼠115天和125天时分别给予4×1011 vg剂量的AAV9-SaCas9-sgRNA5,发现小鼠恢复了的步幅和运动能力(图5 D、E)。
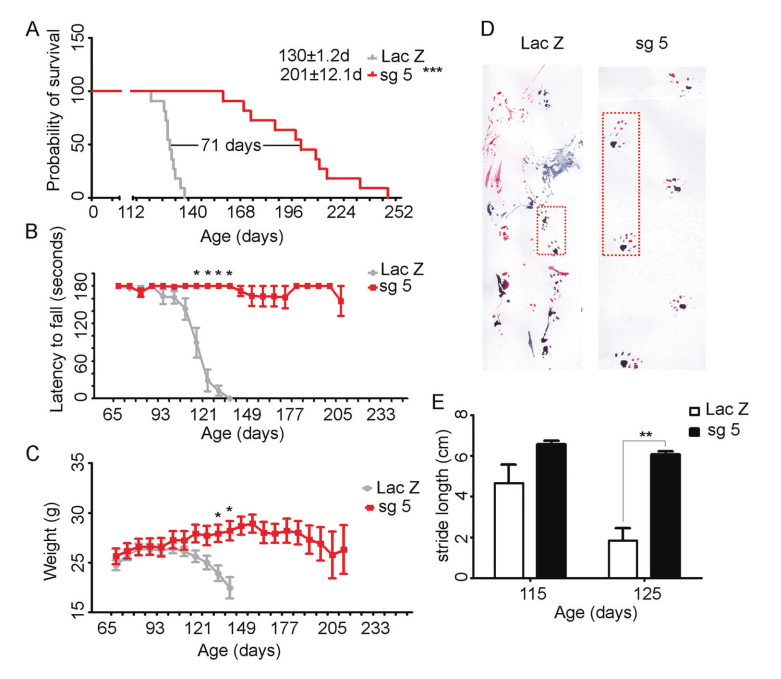
图5 AAV9-SaCas9-sgRNA5对SOD1G93A小鼠的治疗效果。
保留运动神经元:90.9%的脊髓运动神经元被保留(图6 A-C)。
减少神经炎症:AAV9-SaCas9-sgRNA5处理小鼠后,活化的小胶质细胞明显受到抑制,运动神经元的SOD1荧光强度明显减弱(图6 D、E)。
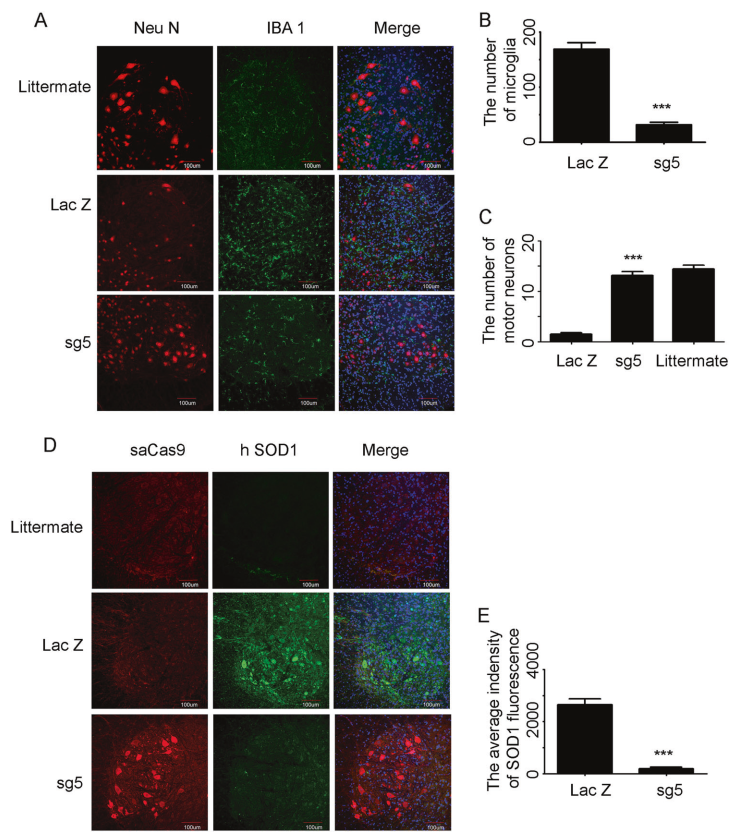
图6 AAV9-SaCas9-sgRNA5(sg5)在较高剂量(4×1011 vg)下给予运动神经元的保护。
降低肌肉萎缩:通过对胫前肌的H&E染色,与对照组相比,使用SaCas9-sgRNA5组出现的肌肉萎缩区域明显减少(图7)。
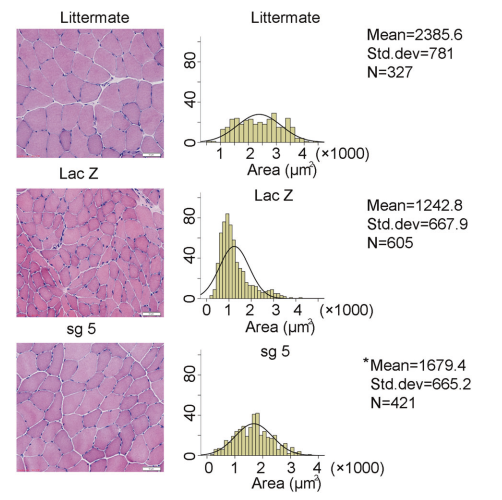
图7 AAV9-SaCas9-sgRNA5治疗小鼠胫前肌面积与对照组比较
2020年诺贝尔化学奖授予了CRISPR-cas9基因编辑技术,该技术能以前所未有的精度来编辑基因组,因此基于AAV-SaCas9-sgRNA的基因编辑对于与SOD1突变相关的ALS患者是一种可行的潜在治疗方法。
